Bom dia! "Do Dalton ao Bohr: Seu Resumo Atômico da Semana" ⚛️
"Cada pequena partícula do seu esforço constrói algo grandioso. Siga em frente, porque o conhecimento, assim como os átomos, é a base de tudo!"
Hoje vamos falar sobre MODELOS ATÔMICOS, que massa né?? Bora lá:
RESUMO
Estrutura Atômica: Modelos, Partículas Subatômicas e a Evolução do Conhecimento
A compreensão da estrutura do átomo evoluiu ao longo do tempo, passando por diferentes modelos teóricos que foram sendo aperfeiçoados à medida que novas descobertas eram feitas. Atualmente, sabemos que o átomo é composto por partículas subatômicas organizadas de forma complexa, mas essa visão surgiu a partir de um longo processo histórico e experimental que a gente vai detalhar já já.
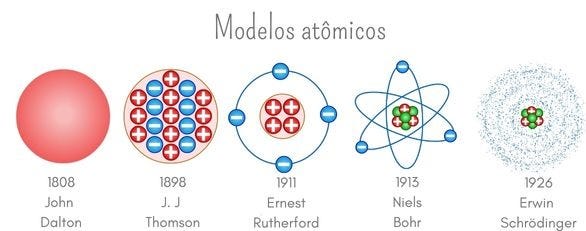
1. Modelos Atômicos: A Evolução da Teoria
1.1. Modelo de Dalton (1803) – A "Bola de Bilhar"
O primeiro modelo atômico foi proposto por John Dalton, baseado em estudos das leis ponderais da química. Segundo ele:
✅ O átomo seria uma esfera maciça, indivisível e indestrutível.
✅ Cada elemento químico possuiria átomos idênticos entre si e diferentes dos átomos de outros elementos.
✅ As substâncias seriam formadas pela combinação de átomos em proporções fixas.
Limitação: Não explicava a existência de cargas elétricas dentro do átomo.
1.2. Modelo de Thomson (1897) – O "Pudim de Passas"
A descoberta do elétron por J.J. Thomson, através de experimentos com tubos de raios catódicos, levou à revisão do modelo de Dalton. Seu modelo sugeria que:
✅ O átomo era uma esfera positiva com elétrons negativos incrustados, como um "pudim de passas".
✅ Os elétrons eram distribuídos uniformemente para equilibrar a carga positiva.
Limitação: Não explicava a existência de um núcleo central e nem a organização dos elétrons.
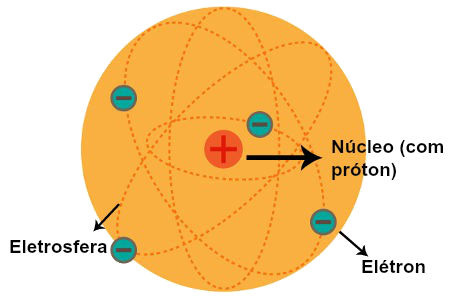
1.3. Modelo de Rutherford (1911) – O "Sistema Solar Atômico"
Com o famoso experimento da lâmina de ouro, Ernest Rutherford bombardeou uma fina folha de ouro com partículas alfa (𝛼) e observou que:
A maioria das partículas atravessava a lâmina sem desvio → o átomo é, na maior parte, espaço vazio.
Algumas partículas sofriam grandes desvios → o átomo possui um núcleo pequeno e positivo.
Raríssimas partículas ricocheteavam → o núcleo é extremamente denso.
Seu modelo propôs que:
✅ O átomo tem um núcleo central positivo contendo prótons.
✅ Os elétrons orbitam ao redor do núcleo em trajetórias indefinidas.
Limitação: Segundo a física clássica, um elétron em movimento contínuo deveria perder energia e colapsar no núcleo, o que não acontece na realidade.
1.4. Modelo de Bohr (1913) – Os Níveis de Energia
Niels Bohr aprimorou o modelo de Rutherford com base em estudos da espectroscopia do hidrogênio, introduzindo os níveis de energia quantizados. Seu modelo afirmava que:
✅ Os elétrons se movem ao redor do núcleo em órbitas circulares bem definidas.
✅ Cada órbita corresponde a um nível de energia fixo (quantização da energia).
✅ Os elétrons podem saltar entre os níveis ao absorver ou liberar energia (fenômeno dos saltos quânticos).
Limitação: Só explicava bem os espectros de átomos hidrogenoides (com apenas um elétron).
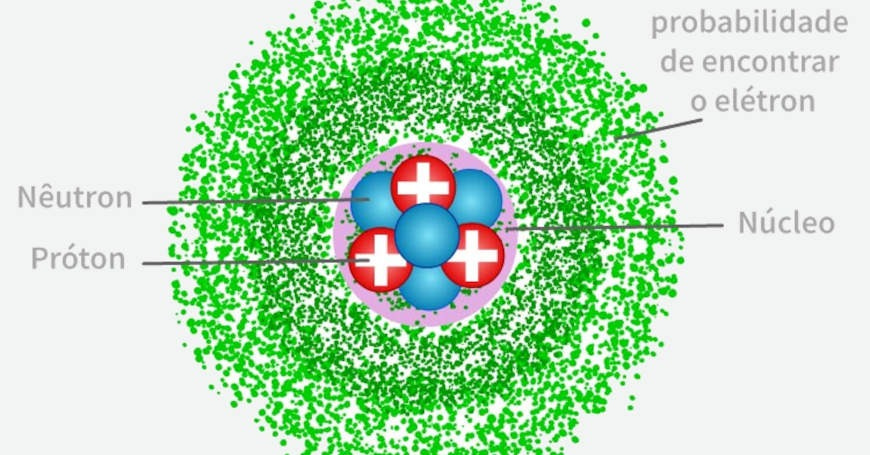
1.5. Modelo Quântico (Atual) – Orbitais Eletrônicos
A partir das ideias da mecânica quântica, cientistas como Schrödinger e Heisenberg desenvolveram um modelo mais avançado. Esse modelo se baseia em:
✅ Orbitais eletrônicos: regiões de maior probabilidade de encontrar um elétron, substituindo as órbitas fixas de Bohr.
✅ Princípio da Incerteza (Heisenberg): não é possível determinar com precisão a posição e a velocidade de um elétron ao mesmo tempo.
✅ Números quânticos: descrevem a posição e o comportamento dos elétrons.
Esse é o modelo aceito atualmente e explica a distribuição eletrônica e o comportamento dos átomos em ligações químicas.
É muita coisa, mas toma um café e vamos continuar. Esse tema é tão certo no ENEM quanto a luz do dia.
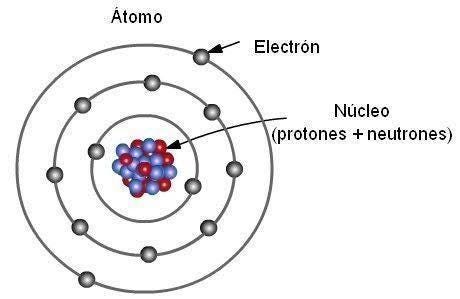
2. Partículas Subatômicas e Estrutura Interna do Átomo
Os átomos não são indivisíveis, como Dalton pensava. Eles são compostos por três tipos principais de partículas subatômicas:
2.1. Prótons (p⁺)
🔹 Carga elétrica: positiva (+1)
🔹 Localização: núcleo
🔹 Determina o número atômico (Z) do elemento, ou seja, a identidade química do átomo.
2.2. Nêutrons (n⁰)
🔹 Carga elétrica: neutra (0)
🔹 Localização: núcleo
🔹 Junto com os prótons, determina o número de massa (A = Z + n).
🔹 Átomos com o mesmo número de prótons, mas diferente número de nêutrons, são chamados de isótopos.
2.3. Elétrons (e⁻)
🔹 Carga elétrica: negativa (-1)
🔹 Localização: camadas eletrônicas ao redor do núcleo
🔹 Responsáveis pelas ligações químicas e pelo comportamento elétrico do átomo.
2.4. Estrutura Geral do Átomo
O átomo é formado por um núcleo extremamente pequeno e denso, contendo prótons e nêutrons, rodeado por uma eletrosfera onde os elétrons estão distribuídos em camadas energéticas.
A evolução dos modelos atômicos mostra como a ciência avança por meio de observações e experimentos. Desde Dalton até o modelo quântico atual, cada teoria contribuiu para um entendimento mais preciso da estrutura da matéria. Hoje, sabemos que os átomos são formados por partículas subatômicas, que interagem entre si e determinam as propriedades dos elementos químicos. Esse conhecimento é essencial para diversas áreas da ciência, desde a química até a nanotecnologia e a física nuclear. Legal, né??
DICAS
Uma dica essencial para mandar bem em Química no Enem é aprender a interpretar gráficos, tabelas e textos científicos. O exame costuma apresentar questões contextualizadas, relacionando a química com temas do dia a dia, como meio ambiente, saúde e tecnologia.
Além disso, é fundamental revisar assuntos como esse de hoje, de estequiometria, eletroquímica, química orgânica e radioatividade, que aparecem com frequência. Em cálculos, sempre confira as unidades e simplifique os valores para facilitar as contas. Na parte teórica, entenda os conceitos ao invés de apenas decorá-los, pois muitas perguntas exigem raciocínio lógico e aplicação do conhecimento em situações práticas.

QUESTÕES
QUESTÃO 1 - ENEM 2019
Em 1808, Dalton publicou o seu famoso livro intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
1. A matéria é constituída de átomos indivisíveis.
2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades.
3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas.
4. Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades.
5. Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos.
Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico.
OXTOBY, D. W.; GILLIS, H. P.; BUTLER, L. J. Principles of Modern Chemistry. Boston: Cengage Learning, 2012 (adaptado).
Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto?
Alternativas
A - 1
B - 2
C - 3
D - 4
E - 5 RESPOSTA 1
QUESTÃO 2 - ENEM 2019
Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida.
A cor observada é proveniente da emissão de radiação eletromagnética ao ocorrer a
Alternativas
A - Mudança da fase sólida para a fase líquida do elemento metálico.
B - Combustão dos cátions metálicos provocada pelas moléculas de oxigênio da atmosfera.
C - Diminuição da energia cinética dos elétrons em uma mesma órbita na eletrosfera atômica.
D - Transição eletrônica de um nível mais externo para outro mais interno na eletrosfera atômica.
E - Promoção dos elétrons que se encontram no estado fundamental de energia para níveis mais energéticos.RESPOSTA 2
ATUALIDADES
Ficar no espaço pode acelerar o envelhecimento dos astronautas, já que a microgravidade e a radiação cósmica afetam músculos, ossos e até o DNA. Além disso, a falta de gravidade faz o corpo "envelhecer" mais rápido. Para combater isso, os astronautas se exercitam e usam tecnologias para se proteger. Afinal, eles estão preparados para sair do planeta, mas não para envelhecer mais rápido! Ninguém tá preparado pra isso na verdade hahahaha. Segue a matéria:
EXPANDINDO SEU REPERTÓRIO SOCIOCULTURAL
O FILME de hoje é MUITO especial, pelo menos para mim e para uma legião de fãs. Em "Robô Selvagem", um robô projetado para ser a máquina perfeita de combate, acaba ganhando algo inesperado: um coração! Depois de um erro cibernético, ele se vê perdido em uma floresta remota, onde precisa aprender a viver sem suas ordens militares. Enquanto enfrenta perigos da natureza e tenta se adaptar a um mundo sem algoritmos, ele faz amizades improváveis com animais e aprende o que realmente significa ser livre. Prepare-se para uma jornada cheia de ação, risadas e emoção, enquanto esse robô tenta encontrar seu lugar no mundo — e talvez até um pouco de humanidade. POR FAVOR ASSISTAM, É IMPOSSÍVEL NÃO GOSTAR!!! Me agradeçam depois.
E assim chegamos ao fim. Tenham um bom dia!!!
"Eu sou uma pessoa em constante mudança, por isso, o que eu sou hoje, amanhã pode ser outra coisa."
Clarice Lispector
RESPOSTA LETRA E.
A resposta correta é E (5), porque os átomos ainda combinam em proporções inteiras para formar compostos, conforme as leis modernas da química.
As outras estão erradas porque:
A (1): Átomos são divisíveis.
B (2): Isótopos têm massas diferentes.
C (3): Nem todos os átomos de um elemento são idênticos em todas as propriedades.
D (4): Átomos podem ser alterados em reações nucleares.
Portanto, apenas o postulado 5 permanece correto.
RESPOSTA LETRA D
Ao receberem energia da chama, elétrons desses cétions metálicos sofrem um a transição eletriônica passando de estados (ou niveis eletronicos) menos energéticos Para outros malis energéticos. Devido à instabilildade dos elétrons nos estados excitados (mais externos), após um breve intervalo de tempo eles retornam aos niveis menos energético s (mais internos) liberando energia na forma de radiação eletromagnética (que, dependendo da sua frequência, pode pertencer à faixa visivel do espectro eletromagnético - luz visivel). As diferentes cores (ou frequências) observadas para diferentes fons se devem às diferenças entre as energias dos niveis eletrônicos de cada substância.